[자료=최종윤 의원실]
식품의약품안전처의 신약 개발 임상 3상 조건부 승인 제도가 부실하다는 지적이 나왔다.
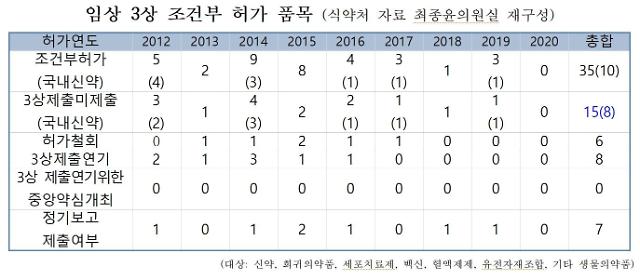
7일 보건복지위원회 소속 최종윤 더불어민주당 의원이 식품의약품안전처(식약처)로부터 제출받은 조건부 허가 품목별 자료에 따르면 지난 10년간 허가 품목 35개 중 15개(42%)가 허가된 지 3년이 지나도 임상시험 결과를 제출하지 않았다.
식약처 기준을 보면 조건부 허가 품목에 대한 임상시험 결과 보고서 제출에는 정해진 기한이 없다. 임상시험 계획서만 제출하도록 하고 있는데, 제약회사가 정한 기간보다 연기될 경우 식약처가 내부 논의와 자문을 거쳐 연기해주고 있다.
또 약품의 허가서에 따르면 임상시험 진행 현황을 계획서에 따라 반기별로 보고하도록 돼 있다. 하지만 임상시험 경과 보고도 전체 35품목 중 7품목만 진행했고 나머지 28품목은 미제출했다. 조건부 허가를 받은 품목 80%가 임상시험 진행 현황을 보고하지 않은 것이다.
아울러 조건부로 허가된 폐암치료제 올리타는 3상 임상시험 중 중대한 부작용이 발견됐음에도 이를 숨겨 주식 시장 교란을 가져오기도 했다. 해당 제품은 한미약품이 개발을 포기한 후 허가가 철회됐다. 지난해 BMJ조사에 따르면 미국 FDA(식품의약국)에서 3상 임상시험을 제출하는 것을 조건으로 허가된 253개 의약품 중 거의 절반에 가까운 112개가 허가된 지 5년 이상이 지났음에도 임상 효과를 검증하지 못한 것으로 드러났다.
최 의원은 “올리타, 리아백스 사태에서 이미 조건부 허가 제도의 문제점이 드러났음에도 식약처는 여전히 이 제도의 관리감독을 허술하게 하고 있다”며 “기존 제도의 관리감독도 부실한데 윤석열 정부가 '글로벌 혁신제품 신속심사 지원체계, GIFT'를 추진한다면 제약회사가 이 제도를 악용하는데 꽃길을 깔아주는 것”이라고 비판했다.
이어 그는 “환자의 치료 기회 확대라는 본래 취지와 다르게 제약 회사의 주가 올리기나 개발을 목적으로 이 제도가 악용되지 않도록 대책을 마련해야 한다”고 덧붙였다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



