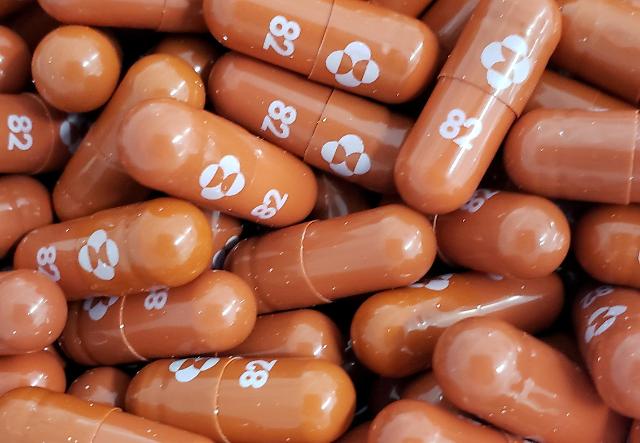
머크의 코로나19 경구용 치료제 '몰누피라비르' [사진=로이터·연합뉴스]
미국 제약사 머크앤드컴퍼니(MSD)가 개발한 신종 코로나바이러스 감염증(이하 코로나19) 경구용(알약) 치료제 '몰누피라비르'에 대한 긴급 사용 승인을 미 식품의약국(FDA)에 신청하면서 코로나19 팬데믹에 새로운 전환점이 될 수 있을지 관심이 쏠리고 있다.
25일 뉴욕타임즈(NYT) 등 미국 현지 언론에 따르면 MSD는 지난 11일 발표한 성명에서 경미하거나 보통 수준의 증세를 보이지만 중증으로 진행할 위험이 있는 코로나19 환자들에 대한 경구용 치료제 '몰누피라비르'의 미국 내 긴급 사용을 승인해달라고 신청했다고 밝혔다.
이에 따라 미 FDA는 승인 여부를 결정하기 위해 몰누피라비르의 안정성과 유효성에 대한 데이터를 검토할 예정이다. 검토 결과는 몇 주 이내에 나올 것으로 전망된다.
FDA가 승인할 경우 몰누피라비르는 전 세계 최초의 코로나19 경구용 치료제가 된다.
몰누피라비르는 무엇보다 경구용 치료제라는 점 때문에 관심이 집중되고 있다. 경구용 치료제는 집에서 환자 스스로 편리하게 복용할 수 있기 때문에 코로나19 환자들이 몰려 과중해진 병원들의 부담을 줄이고, 재확산도 방지할 수 있다는 장점이 있다. 이를 통해 특히 저개발 국가의 코로나19 급격한 확산을 진정시키는 데 도움을 줄 수 있을 것이라 기대받고 있다.
가격도 현재 주사 방식으로 사용되는 치료법보다 3분의1 수준으로 저렴해 코로나19 대응에 있어 큰 전환점이 될 수 있을 것이란 전망이 나온다.
한 명분의 가격은 700달러 수준으로, 집에서 캡슐 4개를 하루 두 번씩 닷새간 먹는 것으로 총 40개를 먹어야 한다.
MSD는 올해 말까지 1000만명분을 생산할 예정이다. 미 연방 정부는 170만명분에 대한 사전구매 계약을 맺었다.
우리 정부도 경구용 치료제 확보전에 합류했다. 정부는 이달 초 MSD와 화이자, 스위스 제약사 로슈와 경구용 코로나19 치료제 협상을 벌이고 있다. 정부는 이미 2만명분을 확보했다고 밝힌 바 있다.
◆화이자·AZ도 치료제 경쟁 합류
MSD 외에도 화이자와 로슈, 아스트라제네카(AZ)도 코로나19 치료제 개발 경쟁에 뛰어들었다.
화이자는 지난 9월 'PF-07321332'에 대한 2·3상을 개시했다. 로슈는 연내 'AT-527'에 대한 2상과 3상 임상 시험 결과를 발표할 계획으로 알려져 있다.
AZ는 코로나19 치료제로 'AZD7442'를 개발 중이다. 최근 이 치료제에 대한 3상 임상 연구의 탑라인 결과를 발표했다.
AZD7442는 코로나19 감염 후 회복기에 접어든 환자가 기증한 B세포에서 파생된 2개의 장기 지속형 항체 '틱사게비맙(tixagevimab, 개발명 'AZD8895')'과 '실가비맙(cilgavimab, 개발명 'AZD1061')'의 조합으로, 미국 밴더빌트 대학교 메디컬센터(Vanderbilt University Medical Center)가 발굴하고 아스트라제네카가 자체 반감기 연장 기술을 접목해 만든 코로나19 예방 및 치료 약물이다.
'AZD7442'는 이미 '노출 전 예방요법'으로 평가한 3상 임상 PROVENT 연구를 통해 위약 대비 증상이 있는 코로나19 발병 위험을 77% 감소시키는 효과를 입증한 바 있다.
또한 'AZD7442'는 아스트라제네카의 반감기 연장 기술이 적용돼 단 1회 투여로 최대 12개월까지 예방 효과가 지속된다. 근육 주사로 투여돼 다른 항체 치료제와 같이 약물 투여를 위해 오랜 시간 동안(약 45분) 병원에 머무르지 않아도 되는 장점도 있다.
◆국산 '먹는 치료제' 임상 6건 진행 중
국내에서도 경구용 치료제 개발이 진행 중이다. 식품의약품안전처에 따르면 국내에서 임상시험에 돌입한 경구용 코로나19 치료제는 신풍제약, 대웅제약, 진원생명과학, 동화약품, 크리스탈지노믹스 등 5곳이다.
지난달 부광약품이 경구용 치료제 후보물질 '레보비르' 개발을 중단하면서 6곳에서 5곳으로 줄었다. 부광약품 측은 두 번째 임상 2상 결과 주평가변수에서 위약대비 레보비르 캡슐의 치료 효과가 통계적으로 유의함을 입증하지 못했다고 밝혔다.
대웅제약은 췌장염 치료제로 사용되 오던 알약 '호이스타정'을 약물재창출 방식을 통해 코로나19 치료제로 개발 중이다.
진원생명과학은 지난달 식약처로부터 후보물질 'GLS-1027(제누졸락)'의 임상2상을 승인받았다. GLS-1027은 면역조절제로 개발 중인 캡슐 형태의 코로나19 치료제로 임상2상은 코로나19 중등증 환자 132명을 대상으로 'GLS-1027'의 안전성과 유효성을 탐색하는 다국가 임상시험이다.
신풍제약은 5곳 중 개발 속도가 가장 빠르다. 신풍제약은 '피라맥스'(피로나리딘·알테수네이트)의 2상 톱라인 결과 바이러스의 음성 전환율은 대조군과 차이가 없었지만 바이러스 억제 효과에 대한 근거와 임상지표의 개선 가능성을 확인했다. 이에 식약처에 임상 3상을 신청, 지난 8월 승인을 받았다. 신풍제약은 내년 8월까지 성인 1420명을 대상으로 임상3상을 마치기로 했다.
동화약품은 코로나19 치료제에 대한 임상 2상을 진행 중이다. 크리스탈지노믹스는 지난해 7월 임상2상 승인을 받은 것으로 알려졌다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지










![[포토] 석촌호수에 나타난 포켓몬 라프라스와 피카츄](https://image.ajunews.com/content/image/2024/04/26/20240426155410280572_388_136.jpg)
![[포토] 악수하는 이재명 대표와 조국 대표](https://image.ajunews.com/content/image/2024/04/26/20240426003606867599_388_136.jpg)
![[포토] 최정, 한국 야구 역사 468호 쾅](https://image.ajunews.com/content/image/2024/04/24/20240424232935147850_388_136.jpg)
![[슬라이드 포토] 성수동이 들썩! 입생로랑 뷰티 팝업 방문한 스타들](https://image.ajunews.com/content/image/2024/04/24/20240424184737983118_388_136.jpg)





![[금투세 폐지 논란] 코리아 디스카운트 심화...韓증시 불확실성 높여](https://image.ajunews.com/content/image/2024/01/03/20240103150426112900_388_136.jpg)
